
嚴重急性呼吸綜合征冠狀病毒2(SARS-CoV-2)是導緻2019年新冠病毒(COVID-19)流行的原因。最近有研究強調了人類血管緊張素轉換酶2(ACE2)分子在介導SARS-CoV-2的細胞進入中的重要作用。與ACE2受體的結合是SARS-CoV-2感染靶細胞的關鍵起始步驟,并且對人類感染至關重要,并且ACE2受體的表達和分布可能與COVID-19的進展和預後相關。
端粒是線性染色體末端的區域,脊椎動物的端粒由大量典型的TTAGGG重複序列組成。shelterin蛋白質複合物與端粒DNA結合,保護端粒DNA不被識别爲DNA損傷(DD),從而防止DDR(DNA損傷反應)。DNA複制導緻染色體的端粒逐漸縮短。當端粒變得非常短時,它們被感知爲DNA雙鏈斷裂(DSB)并激活DDR途徑。小鼠的連續近親繁殖導緻端粒進行性縮短和端粒處的DDR激活,并積累衰老和衰老相關疾病的特征。此外,由于端粒處的損傷不易修複,這會導緻持久的DDR激活。在此篇文章中,來自意大利帕維亞國家研究委員會分子遺傳學研究所的Fabrizio d’Adda di Fagagna教授及其團隊旨在更好的描述端粒縮短和DDR激活後衰老過程中ACE2表達的調節。
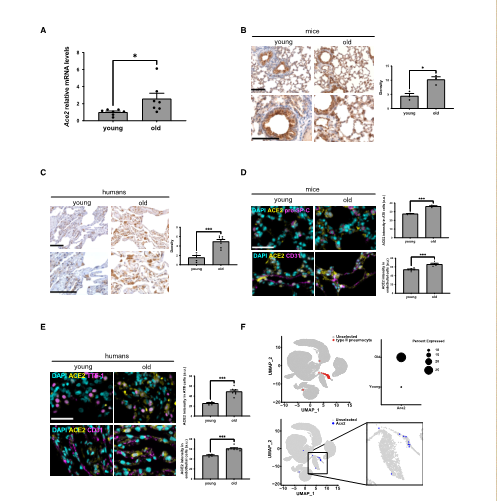
爲了了解衰老過程中ACE2表達的調節,來自意大利的Fabrizio d’Adda di Fagagna教授及其團隊研究了不同年齡的小鼠和人肺中ACE2的表達情況。通過RT-qPCR檢測和免疫組織化學(IHC),觀察到老年小鼠(22-24個月)與年輕小鼠(2-3個月)相比,肺中ACE2 mRNA和蛋白質水平增加。同樣,在人肺中也發現,老年受試者的ACE2蛋白表達水平高于年輕受試者,爲了證實ACE2在ATII細胞中增加,該團隊在不同年齡的肺樣本中對ACE2進行了雙标記免疫熒光檢測,發現無論在小鼠中,還是人類中,随着年齡的增長,ATII肺細胞中ACE2的表達增加。該團隊進一步研究了ACE2轉錄的差異表達,觀察到ACE2在ATII肺細胞中随年齡增長而增加,而管家基因GAPDH在幾乎所有細胞類型中廣泛表達,并且在分析年齡段沒有變化。綜上所述,可以證明,當細胞發生衰老時,ACE2的表達增加,并且ACE2的表達增加主要在ATII肺細胞中。(圖一)
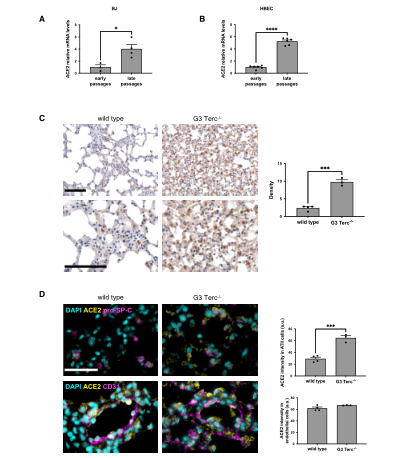
接下來,爲了揭示衰老過程中控制ACE2上調的分子機制,該團隊進行了體外和體内實驗。爲了測試端粒縮短是否足以調節ACE2的表達,該團隊測量了不同人群中人成纖維細胞(BJ)和人支氣管上皮細胞(HBECs)中ACE2的mRNA水平。因爲這兩種細胞類型都缺乏端粒維持機制,并且在增殖時進行性端粒縮短。發現和早期傳代的細胞相比,晚期傳代的BJ和HBEC的ACE2 mRNA水平都有所增加。接下來,該團隊将研究擴展到缺乏端粒酶RNA成分的小鼠模型中,在分析第三代缺乏端粒酶RNA的小鼠中發現與年齡和性别匹配的野生型動物相比,缺乏端粒酶RNA的小鼠ACE2表達持續增加,并且免疫熒光成像顯示,ACE2主要在表達ACE2的ATII肺細胞中增加。并且在pro-SP-C細胞中也觀察到同樣的現象。這些結果清楚地表明端粒縮短在調節人類細胞和小鼠組織中ACE2水平中存在作用。(圖二)
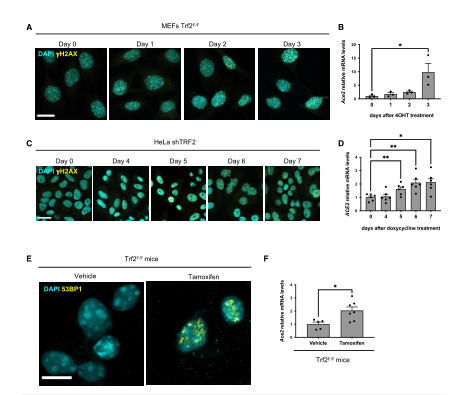
因爲當端粒變得非常短時,它們會激活DNA損傷反應(DDR)途徑。所以接下來該團隊測試端粒DDR是否足以增加ACE2 mRNA水平,該團隊使用了兩種哺乳動物細胞系統,在沒有端粒縮短的情況下,它們允許在端粒處特異性的激活DDR。該團隊敲除TRF2後,發現H2AX病竈水平增加來證明激活了DDR途徑。實驗證明DDR病竈的增加伴随着ACE2 mRNA水平的增加,并且同一細胞系中電離輻射(IR)後,也觀察到同樣的結果,以上證明DDR信号通路在增加ACE2 mRNA的水平上發揮作用。爲了驗證端粒DDR在體内的作用,其團隊在小鼠中用三苯氧胺給藥,誘導TRF2表達缺失,激活端粒處的DDR途徑,觀察到小鼠肝髒中ACE2 mRNA水平的增加。這也證明了以上結果。綜上所述,在人類和小鼠細胞系以及小鼠組織中的這些結果表明,活化的DDR通路在調節ACE2水平方面具有保守的作用。由于在衰老過程中,端粒DDR積累,這可能導緻ACE2水平升高。(圖三)
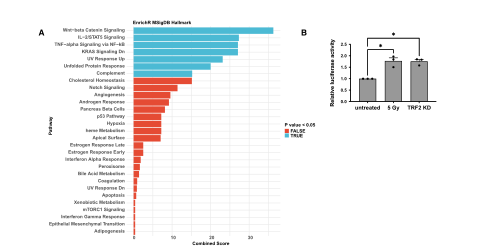
該團隊認爲ACE2 mRNA水平的增加是由其轉錄啓動子活性增強引起的。爲了确定ACE2啓動子是否響應DDR激活,該團隊進行了矽分析,來确定DNA結合基序在ACE2啓動子區域顯著富集的轉錄因子。結果顯示在這些轉錄因子中,存在與DNA損傷反應相關的途徑。該團隊将攜帶熒光素酶報告基因的質粒在人ACE2啓動子的控制下轉染HeLa shTRF2細胞,并通過TRF2敲除誘導端粒DDR,發現熒光素酶信号增加。并且在輻照未誘導的HeLa細胞中DDR激活時也觀察到類似的轉錄激活。這表明DDR途徑通過控制ACE2啓動子活性來增加ACE2 mRNA水平。(圖四)
爲了進一步證明DDR途徑的關鍵成分是導緻觀察到的ACE2 mRNA水平增加的原因。該團隊使用ATM激酶抑制劑KU-60019(ATMi)阻止DDR病竈的形成。發現顯著降低了ACE2 mRNA水平的增加,這表明ATM激酶活性參與了ACE2轉錄水平的調節。爲了研究端粒DDR的抑制是否影響ACE2在體内的表達,該團隊利用端粒反義寡核苷酸(tASOs),實現對端粒DDR的特異性抑制。當處死小鼠并分析其組織時,發現兩種tASO治療都非常有效,并且體内ACE2 mRNA水平下調。接下來,該團隊将研究擴展到第三代端粒縮短的小鼠中,通過雙标記免疫染色發現用tASOs或tASOs治療後,發現ACE2表達明顯較少。這些結果支持ACE2調控是由随後的DDR激活而不是端粒縮短引起的。(圖五)
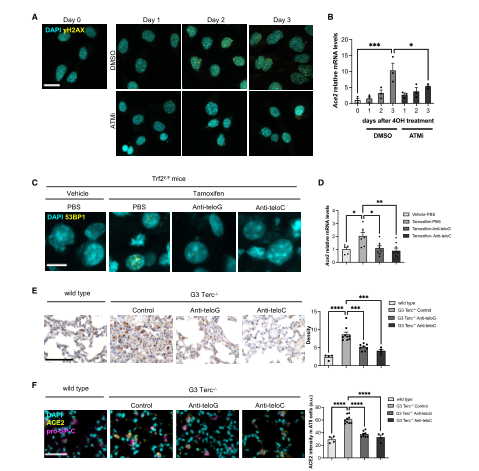
綜上所述,這些結果表明,SARS-CoV-2受體ACE2的表達在轉錄水平上直接受DDR途徑激活的調節,端粒功能障礙是一種能夠參與DDR途徑調節ACE2水平的生理事件。